Réflexions sur les possibilités de transplanter un
greffon d’utérus-vagin chez un homme biologique
Auteur de cet étude : Benjamin LISAN (Email :
benjamin.lisan (at) gmail.com)
Note : Etude
incluse dans ce « Guide transsexuel » : http://benjamin.lisan.free.fr/jardin.secret/EcritsScientifiques/GuideTranssexuel/indexTranssex.htm
Table des matières
1 Présentation des greffes
d’utérus-vagin :
2 Historique de ces
transplantations :
3 Les techniques et
les risques :
3.1 Transplantation
vaginale :
3.3 Technique du don
d’organe :
3.4 Technique de la
culture tissulaire en laboratoire :
3.6 Procédure pour la
transplantation d’utérus :
4.1 Articles généralistes / vulgarisation :
4.2 Articles spécialisés / scientifiques :
4.3 Diaporamas Powerpoint et pdf :
4.4 Articles spécialisés / scientifiques expérimentations sur les
animaux :
5 Centres ayant pratiqués les greffes d’utérus-vagins dans le monde :
6 Spécialistes ayant étudiés ou pratiqués les greffes d’utérus-vagin :
7 Annexe : sur la culture tissulaire de cellule, évitant le risque de rejet
7.1 UN CŒUR NEUF CONTRE LES REJETS
7.2 Un cœur humain quasi transplantable créé à
partir de cellules souches
7.3 Bioengineering du Myocarde humain sur une matrice extracellulaire native
7.4 Bioengineering Human Myocardium
on Native Extracellular Matrix
7.5 SCIENTISTS
GROW FULL-SIZED, BEATING HUMAN HEARTS FROM STEM CELLS
1
Présentation
des greffes d’utérus-vagin :
J’ai lu cet article dans le journal
Direct Matin du 10 novembre 2015 :
"SANTÉ : BIENTÔT DES GREFFES D'UTÉRUS AU CHU DE
LIMOGES ?
Une équipe de gynécologues-obstétriciens du CHU de Limoges va mener prochainement des expérimentations sur des greffes d'utérus provenant de donneuses défuntes, a annoncé hier l'hôpital. Il s'agira d'une première en France. Ce projet vise à permettre à des femmes nées sans utérus, ou ayant subi une hystérectomie (ablation de l'utérus), de pouvoir donner naissance à un enfant."
Source : Direct Matin, Mardi 10 novembre 2015, page 13, http://kiosque.directmatin.fr/Kiosque.aspx?edition=NEP&date=20151110
J’ai toujours pris cette question au
sérieux, parce que je suis transsexuelle, et que j’ai toujours rêvé de pouvoir
bénéficier d’une greffe histocompatible d’utérus-vagin, et que mon rêve, qui
est très sérieux, ne s’est jamais réalisé (et j’ai déjà 60 ans). Je crois que
je suis née 50 ans trop tôt par rapport aux avancées de la science.
Cette dernière solution me
paraissait, a priori, préférable à la solution de la vaginoplastie (°),
pratiquée actuellement pour les transsexuelles à vocation féminine, une
opération qui vous rend définitivement stérile.
Quant à la solution de subir est une
greffe de vagin-utérus provenant de donneuses défuntes, Ce qui m’a
toujours retenu … ce sont les problèmes
d’histocompatibilités (les risques
réels de rejet de la greffe).
En effet, une greffes d'utérus
provenant de donneuses défuntes se heurte vraiment à l’écueil
de l’histocompatibilité HLA, c’est à dire au
risque de rejet de la greffe, si, par exemple,
le transplanté oublie, une seule fois, de prendre son médicament antirejet
(Cyclosporine …), alors qu’il est obligé de le prendre à vie (!). Cette prise à vie d’un médicament antirejet est quand
même une lourde contrainte et elle comporte un certain risque pour sa propre
vie.
Or il semblerait qu’il soit possible
de fabriquer des utérus-vagins à partir de cultures tissulaires, à partir de
ses propres cellules souches, puis de greffer, sur son propre corps,
ensuite, l’utérus-vagin obtenu par culture, … ce qui éviterait, a priori, alors
ces problème d’histocompatibilité. Voir
donc ces articles trouvés sur Internet sur des greffes d’utérus-vagins
obtenus à partir de cultures tissulaires de cellules souches et déjà pratiquées
dans certains hôpitaux dans le monde (voir la bibliographie à ce sujet à la
fin de cet article).
Note : le problème est qu’il faut avoir
le temps de lire tous ces articles.
Voici aussi ce que m’écrivait
justement aussi une amie :
« Concernant la culture de [utérus-]vagin
par cellules souches, des travaux en ce sons ont été effectués en Italie et
donnent des résultats prometteurs. Comme des [utérus-]vagins XY existent (cf.
certaines personnes insensibles aux androgènes etc.) il
n’y aurait pas de problème de génétique [d’histocompatibilité]. [...] tu
verras, sans doute, un jour, des greffes de
vagin fonctionnelles ».
Je reste donc persuadée qu’il est
possible, pour une personne XY, comme moi, de pouvoir être greffée, à partir
d’un utérus-vagin XY _ Mais est-ce vraiment possible, si l’on est de caryotype
XY (?) _, cultivé et obtenu à partir de mes propres cellules souches. Si cette
possibilité existait, je serais prête à attendre 8 ans pour l’obtention d’un
tel utérus-vagin et pouvoir bénéficier d’une telle greffe (et je serais même
prête à payer tous les coûts de la culture tissulaire et le l’opération de
transplantation de mon propre vagin-utérus).
Note : il ne semble pas que l'on a déjà réalisé
des greffons de utérus-vagins XY _ mais a priori, scientifiquement, cette
solution, si elle fonctionnait (?), serait viable, mais nécessiterait une étude
approfondie pour s’assurer de sa fiabilité et « innocuité ».
Problématique ou
difficulté : Au
niveau de la culture tissulaire d’utérus-vagins, qui a été expérimentée sur des
filles de 8 ans, mal formée, le plus gros problème dans l’idée de la culture
tissulaire d’un greffon est comment à partir d’un caryotype XY, pouvoir arriver,
au niveau de l'embryogénèse, à l’orienter et à s'exprimer dans la
"construction" d'un utérus-vagin (c’est une technique encore à
inventer).
Note : Sur
l’embryogénèse d’un utérus-vagin ou d’un pénis et ses anomalies, je recommande
de lire le livre « La bisexualité et
l’ordre de la nature », Claude Aron, Ed. Odile Jacob.
Une autre question qui
m’a toujours préoccupée aussi est comment augmenter la durée de vie des
greffons _ qu’on puisse les faire vivre durant plusieurs années
_ voir les documents ci-joints, :
a) diaporama sur une
solution pour irriguer « tissulairement » les greffons,
b) solution du sang
donneur universel issu d’un ver arénicole,
c) Antigels naturels
destinés à augmenter la durée de vie des greffons, à tester.
Si un jour, cette possibilité de
bénéficier d’une greffe de l’ensemble vagin et utérus était offerte aux
transsexuels à vocation féminine, et que le risque
pour notre vie soit maximisé (bref que le risque soit celui d’une opération
chirurgicale classique sans risque de rejet), je serais la première
candidate à me proposer pour être le cobaye pour la réalisation d’une telle
opération de transplantation de greffe de vagin-utérus auto-compatible.
En attendant, si toutes mes
réflexions pouvaient être aussi utiles à d’autres personnes, cela serait aussi
un de buts, au travers de la rédaction de ce texte.
Cordialement,
Benjamine
PS. Les documents que j’ai rédigés
et cités ci-avant, sont aussi disponibles, en téléchargement libre, sur ma page
Internet « Guide transsexuel » :
http://benjamin.lisan.free.fr/jardin.secret/EcritsScientifiques/GuideTranssexuel/indexTranssex.htm
(°) Voici les inconvénients de la
vaginoplastie, pratiquée actuellement pour les transsexuelles à vocation
féminine, que j’ai relevé, en effectuant le recoupement de plusieurs
témoignages de transsexuelles opérées :
·
Stérilité irréversible,
avec impossibilité définitive d’avoir des enfants.
·
3 mois de
« torture » avec les dilatateurs (selon C.) (sans compter 3 semaines
de souffrance, avec l’obligation de rester immobilisée, dans son lit,
·
(Pas de lubrification naturelle, par exemple, avec
l’opération pratiquée par la majorité des chirurgiens effectuant des
vaginoplasties).
·
(Toutes disent, qu’au niveau sensibilité sexuelle, les
chirurgiens auraient pu faire mieux).
·
Certains vagins
réalisés sont très étroits.
Note : Quand les faits
sont relatés ainsi par les personnes opérées … ils semblent assez dissuasifs.
C’est donc la raison de ce souhait émis par certaines femmes transsexuelles à
vocation féminine (quand à la création d’un vrai pénis fertile, c’est le souhait
de certains hommes transsexuels à vocation masculine).
2 Historique de ces
transplantations :
En 1931, au Danemark, Lili Elbe, une femme transgenre, est morte d’un rejet d'organe, trois mois après avoir reçu une des
premières greffes de l'utérus dans le monde. [5] Avec
la disponibilité de la fécondation in
vitro en 1978, la
recherche sur les transplantations d'utérus a été relancée. [6]
En Arabie saoudite en 2000, une greffe de l'utérus a été
réalisée par le Dr Wafa Fagee, sur une patiente de 26 ans, à partir du greffon
d’une patiente de 46 ans ayant subie une hystérectomie, [7] dont
son utérus avait subi une hémorragie après son
accouchement. L'utérus
transplanté a fonctionné pendant 99 jours, mais finalement, il a dû être retiré
après l'échec en raison de la coagulation du sang. Dans la communauté médicale, il était
un débat quant à savoir si ou non la greffe pourrait vraiment être considéré
comme ayant été couronnée avec succès. [8] En
post-opératoire, le patient a eu deux cycles menstruels spontanés, suivis par l'aménorrhée; la laparotomie exploratoire a confirmé nécrose utérine. La procédure a soulevé certaines
préoccupations morales et éthiques, qui ont été abordés dans la littérature. [9]
En Turquie, le 9 Août 2011, la première transplantation de l'utérus dans
le monde à partir d'un donneur décédé a été menée par une équipe de médecins de l'Université Akdeniz Hospital à Antalya. [10] [11] [12] [13] [14] [15] [ 16] Une
jeune femme turque de
21 ans, Derya Sert, qui était née sans utérus, a été la première femme dans
l'histoire à recevoir un utérus d'un donneur décédé. L'opération, réalisée par
le Dr. Ömer Özkan, le Dr Munire Erman Akar et leur
équipe, a été la première greffe de l'utérus la chirurgie du monde, qui a été
un succès à long terme, comme en témoigne le fait que Mme Sert a eu six
périodes menstruelles post-chirurgie et le fait qu’elle dise avoir un utérus
pleinement opérationnel. L'équipe
médicale turque qui a effectué cette opération délicate, cependant, reste
toujours prudente quant au fait l'opération soit un succès complet. "La chirurgie a été un succès.
Mais nous allons avoir du succès quand elle a son bébé", a déclaré Ozkan. "Pour l'instant, nous sommes
heureux que le tissu est vivant". [17] Le
12 Avril 2013, Université Akdeniz a annoncé que Derya Sert était
enceinte. [18] [19] [20] La
déclaration faite par l'hôpital universitaire a également ajouté que Mme Sert
donnerait naissance par césarienne pour éviter toute complication. Le 14 mai 2013, il a été annoncé que
Mme Sert avait mis fin à sa grossesse à sa 8e semaine suivant un examen de
routine, où les médecins ont échoué à détecter un fœtus battement de coeur. [21]
En Suède en 2012, la première greffe d’utérus sur des filles mère-à-[22] a été effectuée par des médecins suédois à l'hôpital universitaire Sahlgrenska de l'Université
de Göteborg dirigée par Mats
Brännström. [22] [23] [24] Les essais de transplantations d'utérus comporte un total 9
de destinataires (bénéficiaires).
En Octobre 2014, il a été annoncé que, pour la première
fois, un bébé en bonne santé était né chez une bénéficiaire d’une greffe
utérine, dans un endroit inconnu en Suède. La revue médicale britannique The Lancet a indiqué que le petit garçon était né
en Septembre, pesant 1,8 kg (3,9 lb) et que le père avait dit que son fils
était « étonnant ». Le bébé avait
été livré prématurément à environ 32 semaines, par césarienne, après que la mère avait développé une pré-éclampsie. La femme suédoise, âgé de 36 ans,
avait reçu un utérus en 2013, d'une donneuse de 61 ans donateurs, dans une
opération dirigée par le Dr Brännström, professeur d'obstétrique et de
gynécologie à l'Université de Göteborg. [25] [26]
La femme avait des ovaires sains, mais a été née
sans utérus, une maladie qui touche environ une
personne sur 4.500 femmes. La
procédure utilise un embryon créé, en laboratoire, à l'aide de l'ovule de la
femme et le sperme de son mari, qui a ensuite été implanté dans l'utérus
transplanté. L'utérus peut avoir
été endommagé au cours de l'accouchement par césarienne et il peut ou peut ne
pas être approprié pour de futures grossesses. Un régime d'immuno-suppression triple
a été utilisé avec le tacrolimus, l’azathioprine et des corticostéroïdes. Trois épisodes
de rejet doux eu lieu, l'une au cours de la grossesse, mais ont été supprimés
tous les succès avec des médicaments. Quelques
autres femmes, aux utérus transplantés, ont également été signalés à être
enceinte, à ce moment. La mère
sans nom, qui a reçu un don d’un utérus d'une amie, a dit qu'elle espérait que
le traitement serait affiné pour aider les autres, à l'avenir. [27]
La greffe est destinée à être temporaire - la bénéficiaire
va subir une hystérectomie après une ou deux grossesses réussies. Ceci afin d'éviter la nécessité pour
elle de prendre des
médicaments immunosuppresseurs à
vie avec un risque accru d'infection
consécutive. [28]
Le projet de recherche de l'utérus de la transplantation à
l'Université de Göteborg, qui a commencé en 1999, a été évalué dans plus de 40
articles scientifiques. [29] La
procédure reste le dernier recours - il est cher et pas susceptibles d'être
couverts par l'assurance et, contrairement à d'autres méthodes d'assistance et
de traitement de fertilité, est une procédure relativement nouvelle et quelque
peu expérimentale, effectuée seulement par certains chirurgiens spécialisés
dans certains centres, où les risques découlent d'une opération de
transplantation d'organe relativement invasive, y compris l'infection et le
rejet d'organe. Certains spécialistes de l’éthique considèrent
que les risques à un donneur vivant, par opposition à un donneur post-mortem,
comme étant trop grand, et certains trouvent toute la procédure éthiquement
discutable, d'autant plus que la greffe ici n’est pas une procédure de
sauvetage. [30] [ 31] [32]
Source : https://en.wikipedia.org/wiki/Uterus_transplantation
3 Les techniques et les
risques :
3.1 Transplantation vaginale :
La Transplantation vaginale est une procédure expérimentale lequel un don ou cultivées en laboratoire vagin est transplanté dans une femme qui a aplasie
vaginale (une condition où le vagin ne se forme
pas correctement avant la naissance) ou un vagin qui a été endommagé par la
maladie. Bien qu'il ait été réalisées uniquement sur quelques femmes,
la transplantation semble offrir une meilleure fonctionnalité de la greffe, le traitement
traditionnel pour aplasie.
3.2 Le contexte :
L’Aplasie
vaginale est une condition médicale rare dans
lequel le vagin ne se forme pas correctement avant la naissance. Les personnes atteintes de la maladie
peuvent avoir un vagin partiellement formés, ou pas du tout. La condition est habituellement
traitée par chirurgie reconstructive. D'abord,
un espace est créé chirurgicalement où existerait généralement le vagin. Ensuite,
le tissu d'une autre partie du corps est récolté, moulé dans la forme d'un
vagin, et greffés dans la cavité vaginale. Cette
technique présente des inconvénients importants. Typiquement, le tissu greffé
ne fonctionne pas normalement comme un muscle, ce qui peut conduire à une
faible jouissance des rapports sexuels. En outre, la sténose (rétrécissement de la cavité) peut se produire au fil du temps. [1] La
plupart des femmes ont besoin de multiples interventions chirurgicales devant
un résultat satisfaisant. [2] Une
alternative à la chirurgie reconstructive traditionnelle est la
transplantation.
3.3 Technique du don
d’organe :
Dans une poignée de cas, une femme avec aplasie vaginale
a reçu une greffe du vagin succès offert par sa mère. [3] Le
premier cas est censé avoir eu lieu en 1970, sans aucun signe de rejet ayant
lieu après trois ans. [4 ] Dans
au moins un cas, une femme qui a reçu une greffe a été en mesure de concevoir
et de donner naissance. [5] En
1981, une jeune fille de 12 ans avec aplasie vaginale reçu un implant de la
paroi vaginale de sa mère. Elle
est devenue active sexuellement sept ans plus tard, sans incident. À 24 ans, elle a conçu et réalisé un
enfant à terme.L'enfant est né par césarienne. [6]
3.4 Technique de la culture
tissulaire en laboratoire :
En Avril 2014, une équipe de scientifiques dirigée par Anthony Atala a rapporté qu'ils avaient transplanté
avec succès vagins cultivées en laboratoire en quatre adolescentes femmes avec
une condition médicale rare appelée syndrome
de Mayer-Rokitansky-Küster-Hauser qui
provoque le vagin pour développer de manière incorrecte, ou parfois pas du
tout. [7] Entre
1 sur tous les 1500 et 1 sur chaque 4.000 femmes sont nés avec cette condition. [1]
Les quatre patients ont commencé le traitement, entre mai
2005 et Août 2008. [1] Dans
chaque cas, l'équipe de recherche médicale a commencé en prenant un petit
échantillon de tissu génital partir de l'adolescent la vulve. [8] L'échantillon
a été utilisé comme une graine de croître supplémentaires tissu dans le
laboratoire, qui a été ensuite placé dans une forme vaginale, moule
biodégradable. [7] cellules
vaginales de garniture ont été placés à l'intérieur du tube, tandis que les
cellules musculaires sont attachés à l'extérieur. [8] Cinq
à six semaines plus tard, la structure a été implanté dans les patients, où le
tissu a continué de croître et en liaison avec les systèmes corporels de la
circulation et d'autres des filles. [1] [7] Après
environ huit ans, tous les quatre patients ont rapporté des niveaux de fonction
et de plaisance normales lors des rapports sexuels selon la Femme sexuelle
questionnaire Function Index, un outil d'auto-rapport validé. Pas de résultats ou de complications
indésirables ont été rapportés. [1]
Dans deux des quatre femmes, le vagin a été attaché à l'utérus, ce
qui rend possible la grossesse. Aucune
grossesse n'a été signalé, toutefois, au cours de la période d'étude. Martin
Birchall, qui travaille sur l'ingénierie tissulaire, mais n'a pas participé à l'étude, a
déclaré qu'il "a répondu à certaines des questions les plus importantes
auxquelles fait face la traduction des technologies de l'ingénierie
tissulaire." [8] Commentaire
publié par le National Health
Service (NHS) a appelé
l'étude "une preuve importante de concept» et a dit qu'il a montré que
l'ingénierie tissulaire avait "beaucoup de potentiel." [1] Toutefois,
le NHS a également averti que la taille de l'échantillon était très petit et de
plus amples recherches était nécessaire pour déterminer la viabilité générale
de la technique. [1]
La technique de transplantation
cultivées en laboratoire pourrait également être utilisé sur les femmes qui ont
besoin de chirurgie reconstructive en raison d'un cancer ou d'autres maladies
une fois que la technique se perfectionne. [7] Cependant, d'autres études devront être
menées et les techniques développé avant la production commerciale peut
commencer . [8]
3.5 Références :
1. Bazian (April 11, 2014). "Lab-grown vaginas successfully implanted".
NHS (UK). Retrieved May 17, 2014.
2.
Melissa
C. Davies; Sarah M. Creighton; Christopher R.J. Woodhouse (June 2005).
"The pitfalls of vaginal construction". BJU International 95 (9): 1293–98. doi:10.1111/j.1464-410x.2005.05522.x.
3.
G
Belleannée; J L Brun; H Trouette; J P Mompart; J F Goussot; G Brun; A de
Mascarel (July–August 1998). "Cytologic Findings in a Neovagina Created
with Vecchietti's Technique for Treating Vaginal Aplasia". Acta Cytol 42 (4): 945–8. doi:10.1159/000331973.
4.
Dennis
Sanders (1982). The First of Everything. p. 117.
5.
Atef M.M. Darwish (June 2010). "Fine needle
vaginoplasty: a simplified novel approach for correction of vaginal
aplasia". Fertility and Sterility 94 (1): 309–312. doi:10.1016/j.fertnstert.2009.02.006.
6.
Prapas; Papanicolaou; Prapas; Goutzioulis; Papanicolaou (1993). "Term pregnancy after vaginal transplantation in a
case of vaginal agenesis with a functional uterus". Acta Europaea Fertilitatis 24 (2): 77–78.
7.
Kim
Painter (April 11, 2014). "Lab-grown vaginas and nostrils work, doctors
report". USA Today.
Retrieved April 12, 2014.
8.
James
Gallagher (April 10, 2014). "Doctors implant lab-grown vagina".
BBC. Retrieved April 12, 2014.
Source : https://en.wikipedia.org/wiki/Vaginal_transplantation
3.6 Procédure pour la
transplantation d’utérus :
La transplantation de l'utérus commence avec la chirurgie
de récupération de l'utérus sur un donneur. Les
techniques de travail pour cette opération existent pour animaux, y compris les
primates et, plus récemment, chez l'homme. [33] [34] [35] [36] [37] [38] L'utérus
récupéré peut avoir besoin d'être stocké, par exemple pour le transport vers le
lieu de le récipient. Des études
sur une ischémie/eperfusion froide indiquent une tolérance ischémique de
plus de 24 heures. [34]
Le bénéficiaire doit considérer potentiellement trois
chirurgies majeures. Tout
d'abord, il y a la chirurgie de transplantation. Si une grossesse est établie et peut
être conduite d’une manière viable, une césarienne est effectuée. Comme le bénéficiaire est traitée avec une thérapie immunosuppressive, finalement, après l'achèvement de la
procréation, une hystérectomie doit être fait, de sorte que le
traitement immunosuppresseur peut être supprimé.
3.7
Références :
1. Knauer, Emil (1896). "Einige Versuche über
Ovarientransplantation bei Kaninchen" [An attempt at ovary transplantation
in rabbits]. Zentralblatt für Gynäkologie (in German) 20: 524–8.
2.
Nugent,
D.; Meirow, D.; Brook, P. F.; Aubard, Y.; Gosden, R. G. (1997).
"Transplantation in reproductive medicine: Previous experience, present
knowledge and future prospects". Human Reproduction Update 3 (3): 267–80. doi:10.1093/humupd/3.3.267. PMID 9322102.
3.
Eraslan,
S.; Hamernik, R. J.; Hardy, J. D. (1966). "Replantation of uterus and
ovaries in dogs, with successful pregnancy". Archives of surgery 92 (1): 9–12.doi:10.1001/archsurg.1966.01320190011002. PMID 5948103.
4.
Díaz-García,
César; Akhi, Shamima N.; Wallin, Ann; Pellicer, Antonio; Brännström, Mats.
"First report on fertility after allogeneic uterus transplantation". Acta Obstetricia et Gynecologica Scandinavica 89 (11): 1491–1494. doi:10.3109/00016349.2010.520688.
5.
"Nicole
Kidman as the world's first reported woman with surgically corrected Harry
Benjamin Syndrome". Shb-info.org. Retrieved 2012-11-20.
6.
Confino
E., Vermesh M., Thomas W., Gleicher N. (1986). "Unilateral rabbit uterus
transplantation model". Int J Obstet Gynaecol 24: 321–325.
7.
Nair,
Anjana; Stega, Jeanetta; Smith, J. Richard; Del Priore, Giuseppe (2008).
"Uterus Transplant". Annals of the New York Academy of Sciences 1127: 83–91.doi:10.1196/annals.1434.003. PMID 18443334.
8.
Grady,
Denise (March 7, 2002). "Medical First: A Transplant Of a Uterus". The New York Times.
9.
Lefkowitz, Ariel; Edwards, Marcel; Balayla, Jacques (2012). "The Montreal Criteria for the Ethical Feasibility of
Uterine Transplantation". Transplant International 25 (4): 439–47.doi:10.1111/j.1432-2277.2012.01438.x. PMID 22356169.
10. "Turkish woman has world's first womb
transplant". timesofmalta.com. Retrieved 2012-11-21.
11. "Revolutionary ‘Womb Transplant’ performed in Turkey
- World’s First". Allvoices.com. Retrieved 2012-11-21.
12. "World’s first successful uterus transplant
performed in Turkey — RT". Rt.com. Retrieved2012-11-21.
13. "World’s first womb transplant in Turkey promises
hope for women". Alarabiya.net. 2011-10-01. Retrieved 2012-11-21.
14. "HEALTH - Doctors hopeful for uterus
transplant". Hurriyetdailynews.com. 2011-09-13. Retrieved 2012-11-21.
15. "World's first uterus transplant performed in
Turkey/TRT-English". Trt-world.com. 2012-02-27. Retrieved 2012-11-21.
16. "Turkish surgeons perform world's first uterus
transplant | Family & Health". World Bulletin. Retrieved 2012-11-21.
17. "World's first successful uterus transplant
performed in Turkey". Rt.com. October 2011. Retrieved 2012-11-20.
18. "Womb transplant recipient Derya Sert pregnant".
AAP. 2013-04-13.
19. "Yahoo Health". Retrieved 5 October 2014.
20. "World’s first woman with uterus transplant gets
pregnant - HEALTH". Retrieved 5 October2014.
21. Derya Sert'in gebeliği sonlandırıldı.
CNNTurk.com. (Turkish)
22. Brännström, Mats; Johannesson, Liza; Dahm-Kähler,
Pernilla; Enskog, Anders; Mölne, Johan; Kvarnström, Niclas; Diaz-Garcia, Cesar;
Hanafy, Ash; Lundmark, Cecilia; Marcickiewicz, Janusz; Gäbel, Markus; Groth,
Klaus; Akouri, Randa; Eklind, Saskia; Holgersson, Jan; Tzakis, Andreas;
Olausson, Michael. "First clinical uterus transplantation trial: a
six-month report".Fertility and Sterility 101 (5): 1228–1236. doi:10.1016/j.fertnstert.2014.02.024
23. Brännström, Mats; Diaz-Garcia, Cesar; Hanafy, Ash;
Olausson, Michael; Tzakis, Andreas. "Uterus transplantation: animal
research and human possibilities". Fertility and Sterility 97 (6): 1269–1276. doi:10.1016/j.fertnstert.2012.04.001.
24.
Brännström,
M.; Wranning, C. A.; Altchek, A. (7 November 2009). "Experimental uterus
transplantation". Human Reproduction Update 16 (3): 329–345. doi:10.1093/humupd/dmp049.PMID 19897849.
25.
"Woman has healthy baby boy after womb transplant in
Sweden". ABC News.
26.
Brännström,
M.; Johannesson, L.; Bokström, H.; Kvarnström, N.; Mölne, J.; Dahm-Kähler, P.;
Enskog, A.; Milenkovic, M.; Ekberg, J.; Diaz-Garcia, C.; Gäbel, M.; Hanafy, A.;
Hagberg, H.; Olausson, M.; Nilsson, L. (2014). "Livebirth after uterus
transplantation". The Lancet.doi:10.1016/S0140-6736(14)61728-1.
27.
"BBC
News - Womb transplant couple 'had no doubt' of success". BBC News.
28.
Ossola,
Alexandra (18 February 2014). "Everything You Need To Know About Uterus
Transplants". Popular Science. Retrieved 10 October 2014.
29.
"World's first child born after uterus transplantation". ScienceDaily.
30.
"Medical first: Baby born to woman who got new
womb". Journal Star (2006-2014 Gatehouse Media, Inc.). 4 October 2014. Retrieved 4 October 2014.
31.
"BBC News". BBC News.
Retrieved 5 October 2014.
32.
"The Daily Telegraph". Telegraph.co.uk. 3 October 2014. Retrieved 5 October 2014.
33.
Johannesson,
Liza; Diaz-Garcia, Cesar; Leonhardt, Henrik; Dahm-Kähler, Pernilla;
Marcickiewicz, Janusz; Olausson, Michael; Brännström, Mats. "Vascular
Pedicle Lengths After Hysterectomy". Obstetrics & Gynecology 119 (6): 1219–1225.doi:10.1097/AOG.0b013e318255006f.
34.
Brännström,
M.; Wranning, C. A.; Altchek, A. (2009). "Experimental uterus
transplantation".Human Reproduction Update 16 (3): 329–45. doi:10.1093/humupd/dmp049.PMID 19897849.
35.
Wranning,
C. A.; Akhi, S. N.; Diaz-Garcia, C.; Brännström, M. (15 December 2010).
"Pregnancy after syngeneic uterus transplantation and spontaneous mating
in the rat". Human Reproduction26 (3): 553–558. doi:10.1093/humrep/deq358.
36.
Enskog,
A.; Johannesson, L.; Chai, D. C.; Dahm-Kahler, P.; Marcickiewicz, J.; Nyachieo,
A.; Mwenda, J. M.; Brännström, M. (2 June 2010). "Uterus transplantation
in the baboon: methodology and long-term function after
auto-transplantation". Human Reproduction 25 (8): 1980–1987. doi:10.1093/humrep/deq109.
37.
Dahm-Kähler,
Pernilla; Wranning, Caiza; Lundmark, Cecilia; Enskog, Anders; Mölne, Johan;
Marcickiewicz, Janusz; El-Akouri, Randa Racho; McCracken, John; et al.
"Transplantation of the uterus in sheep: Methodology and early reperfusion
events". Journal of Obstetrics and Gynaecology Research 34 (5): 784–793. doi:10.1111/j.1447-0756.2008.00854.x.
38.
Wranning,
Caiza Almen; El-Akouri, Randa Racho; Lundmark, Cecilia; Dahm-Kahler, Pernilla;
Molne, Johan; Enskog, Anders; Brännström, Mats. "Auto-transplantation of
the uterus in the domestic pig (Sus scrofa): Surgical technique and early
reperfusion events". Journal of Obstetrics and Gynaecology Research 32 (4): 358–367. doi:10.1111/j.1447-0756.2006.00426.x.
39.
Lefkowitz
A., Edwards M., Balayla J. (2012). "O081 THE MONTREAL CRITERIA FOR THE
ETHICAL FEASIBILITY OF UTERINE TRANSPLANTATION". International Journal of Gynecology & Obstetrics 119 (Supplement 3): S289. doi:10.1016/S0020-7292(12)60511-6.
40.
Ethical
considerations in the era of the uterine transplant: an update of the Montreal
Criteria for the Ethical Feasibility of Uterine Transplantation.A Lefkowitz, M
Edwards, J Balayla - Fertility and Sterility, 2013. doi:10.1016/j.fertnstert.2013.05.026
41.
Moore
FD. "Ethical problems special to surgery: surgical teaching, surgical
innovation, and the surgeon in managed care". Arch Surg 2000;135:14-16.
Source :
https://en.wikipedia.org/wiki/Uterus_transplantation
4 Bibliographie :
4.1
Articles
généralistes / vulgarisation :
1. http://secouchermoinsbete.fr/55906-il-est-possible-d-implanter-des-vagins-cultives-en-laboratoire
2. http://www.huffingtonpost.fr/2014/04/11/greffe-vagin-nez-ingienerie-tissulaire_n_5133421.html
3. http://www.directmatin.fr/sante/2014-10-04/premiere-naissance-partir-dun-uterus-greffe-692486
4. http://www.lapresse.ca/vivre/sante/201406/17/01-4776626-cultiver-des-organes-en-labo.php
5. (http://news.doccheck.com/fr/2224/ingenierie-tissulaire-depassement-cellulaire/ ).
6. Italian doctor builds new, more natural vagina, Stephen Brown, 30 mai 2007, http://www.reuters.com/article/2007/05/30/us-italy-vagina-idUSL3069953820070530
7. Designer vaginas grown in lab, Stephen Brown, http://www.abc.net.au/science/articles/2007/05/31/1938525.htm
8. Lab-Grown Private Parts: Vagina Implants Cure Rare Disorder, JONEL ALECCIA, http://www.nbcnews.com/health/health-news/lab-grown-private-parts-vagina-implants-cure-rare-disorder-n77136
- Huit ans après, des vagins cultivés en
laboratoire et implantés fonctionnent très bien, 11 avril 2014, http://www.gurumed.org/2014/04/11/huit-ans-aprs-des-vagins-cultivs-en-laboratoire-et-implants-fonctionnent-trs-bien/
- Greffe de vagin : une première opération
réussie, 11/04/2014, http://www.huffingtonpost.fr/2014/04/11/greffe-vagin-nez-ingienerie-tissulaire_n_5133421.html
11.
Vaginal
transplantation, https://en.wikipedia.org/wiki/Vaginal_transplantation
- Uterus transplantation, https://en.wikipedia.org/wiki/Uterus_transplantation
- http://wombtransplantuk.org/ & http://wombtransplantuk.org/position/trustees
4.2
Articles
spécialisés / scientifiques :
1. Vaginoplasty using autologous in vitro cultured vaginal tissue in a
patient with Mayer–von-Rokitansky–Küster–Hauser syndrome, Pierluigi Benedetti Panici,
Filippo Bellati, Terenzio Boni, Federica Francescangeli, Luigi Frati and Cinzia
Marchese, http://humrep.oxfordjournals.org/content/22/7/2025.full
- b) Tissue-engineered
autologous vaginal organs in patients: a pilot cohort study, Prof
Atlántida M Raya-Rivera, MD, Prof Diego Esquiliano, MD, Prof Reyna
Fierro-Pastrana, MD, Prof Esther López-Bayghen, Ph.D., Prof Pedro
Valencia, MD, Prof Ricardo Ordorica-Flores, MD, Prof Shay Soker, Ph.D.,
Prof James J Yoo, Ph.D., Prof Anthony Atala, MD, http://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2814%2960542-0/abstract
- c) Characterization of Human
Vaginal Mucosa Cells for Autologous In Vitro Cultured Vaginal Tissue
Transplantation in Patients with MRKH Syndrome, Cristina Nodale,
Enrica Vescarelli, Sirio D’Amici, Diana Maffucci, Simona Ceccarelli, Marco
Monti, Pierluigi Benedetti Panici, Ferdinando Romano, Antonio Angeloni,
and Cinzia Marchese, BioMed Research International, Volume 2014 (2014),
Article ID 201518, 6 pages, http://www.hindawi.com/journals/bmri/2014/201518/
- e) Engineered vaginas grown
in women for the first time, 10/04/2014, https://www.newscientist.com/article/dn25399-engineered-vaginas-grown-in-women-for-the-first-time
- Mats Brannstrom - Human Uterus Transplantation at the 17th COGI
Congress, https://www.youtube.com/watch?v=kxhl2TPlUJk
- Livebirth after uterus
transplantation,
Prof Mats Brännström, MD, Liza Johannesson, MD, Hans Bokström, MD, Niclas
Kvarnström, MD, Johan Mölne, MD, Pernilla Dahm-Kähler, MD, Anders Enskog,
MD, Milan Milenkovic, MD, Jana Ekberg, MD, Cesar Diaz-Garcia, MD, Markus
Gäbel, MD, Ash Hanafy, MD, Prof Henrik Hagberg, MD, Prof Michael Olausson,
MD, Lars Nilsson, MD, http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(14)61728-1/abstract
- EVERYTHING YOU NEED TO KNOW
ABOUT UTERUS TRANSPLANTS, Alexandra Ossola, 18/02/2014, http://www.popsci.com/blog-network/ladybits/everything-you-need-know-about-uterus-transplants
- [5]
Bulletti C, Palagiano A, Pace C, Cerni A, Borini A, de Ziegler D. The artificial womb. Ann N Y Acad
Sci. 2011, 1221: 124-8
- [6] Chavatte-Palmer P, Lévy R, Boileau P. Une reproduction sans utérus ? Etat des lieux de
l’ectogénèse. Gynecol
Obstet Fertil. 2012, 40: 695-7
- [7]
Schoberer M, Arens J, Lohr A, Seehase M, Jellema RK, Collins JJ, Kramer
BW, Schmitz-Rode T, Steinseifer U, Orlikowsky T. Fifty years of work on the artificial placenta: milestones in
the history of extracorporeal support of the premature newborn. Artif
Organs. 2012, 36: 512-6
- [10] Raya-Rivera AM, Esquiliano D,
Fierro-Pastrana R, López-Bayghen E, Valencia P, OrdoricaFlores R, Soker S,
Yoo JJ, Atala A. Tissue-engineered
autologous vaginal organs in patients: a pilot cohort study. Lancet.
2014 , 384: 329-36..
- [11]
Cervelló I, Mas A, Gil-Sanchis C, Peris L, Faus A, Saunders PT, Critchley
HO, Simón C. Reconstruction of
endometrium from human endometrial side population cell lines. PLoS
One. 2011, 6: e21221.
- [12]
Birchall MA, Seifalian AM. Tissue
engineering's green shoots of disruptive innovation. Lancet. 2014,
384: 288-90
4.3
Diaporamas
Powerpoint et pdf :
- Uterine transplant_birth of baby Vincent as shared by Brannstrom
and team, Vijayalakshmi
Pillai, Medical Director at Vijayalakshmi Medical Centre, octobre 2014, http://fr.slideshare.net/vijayalakshmipillai/uterine-transplant-birth-of-baby-vincent-as-shared-by-brannstrorm-snd-team (même document, stocké en local, sur ce
site).
- Livebirth
after A uterus transplantation, Chloé DESPRES – Valentin
RENAUX, octobre 2014, http://moodle.univ-lille2.fr/mod/resource/view.php?id=29323&redirect=1
(même
document, stocké en local, sur ce site).
- Surgical management of
congenital uterine anomalies, http://edc.mui.ac.ir/sites/edc.mui.ac.ir/files/Surgical%20management%20of%20congenital%20uterin.pptx
- Uterus transplantation – myth or reality ?, Mats Brännström, Department
of Obstetrics & Gynecology, The Sahlgrenska Academy at University of
Gothenburg, Sweden, http://www.gyndolomiti.com/vortraege/prof.braennstroem.pdf (même document, stocké en local, sur ce
site).
- Uterine transplantation, Mats Brännström, Department of
Obstetrics & Gynecology, The Sahlgrenska Academy at University of
Gothenburg, Sweden, http://claradoc.gpa.free.fr/doc/157.pdf (même document, stocké en local, sur ce
site).
- Uterus Transplantation, Ömer Özkan, Akdeniz University Faculty
of Medicine, Department of Plastic and Reconstructive Surgery, Antalya,
Turkey, http://www.ggg-b.de/_download/unprotected/oezkan_oe_uterus_transplantation.pdf (même document, stocké en local, sur ce
site).
- Assisted reproduction techniques, http://science.jburroughs.org/mbahe/BioEthics/ppt_pdf/015AssistedReproduction.pdf
- The Future of Female Urology,
Karl J. Kreder,
MD, MBA, University of Iowa Department of Urology, http://www.grandroundsinurology.com/wp-content/uploads/2015/09/0830_0840.Kreder.pdf
- PRETRANSPLANT IMMUNOLOGIC RISK
ASSESMENT FOR IMMUNOSUPPRESSIVE MANAGEMENT OF KIDNEY TRANSPLANT RECIPIENTS, Enver Akalin, M.D.,
Montefiore Medical Center, Bronx, NY, http://www.tsn.org.tr/folders/file/hekimlik/salon1/Enver_Akalin_Pretransplant_Immunologic_Risk.pdf (même document, stocké en local, sur ce
site).
- Reproductive Health: Myths,
Legends and misCONCEPTIONS, G. Wright Bates, Jr., M.D., Professor and Director, Reproductive
Endocrinology and Infertility, University of Alabama at Birmingham, https://www.uab.edu/medicine/obgynresidency/images/Progress/Syllabi/RN/TH_3_Bates.pdf (même document, stocké en local, sur ce
site).
- The Ethics of Uterine
Transplantation.
Obstetrics and Gynecology Grand Rounds, IWK Health Centre. Wednesday
January 28, 2015. Angel Petropanagos, Ph.D., Novel Tech Ethics, Faculty of
Medicine, Dalhousie University, http://obstetrics.medicine.dal.ca/news/documents/PetropanagosOBGYNGrandRounds-EthicsofUTxJan282015.pdf (même document, stocké en local, sur ce
site).
4.4
Articles
spécialisés / scientifiques expérimentations sur les animaux :
[1]
Rivera-Pérez JA, Jones V, Tam PP. Culture of whole mouse
embryos at early postimplantation to organogenesis stages: developmental
staging and methods. Methods Enzymol. 2010, 476: 185-203.
[2] Carlston C. Artificial wombs. Harvard Science
Review, 2008, 35-9
[3] Unno N,
Baba K, Kozuma S, Nishina H, Okai T, Kuwabara Y, Taketani Y. An evaluation of the system to control blood
flow in maintaining goat fetuses on arterio-venous extracorporeal membrane
oxygenation: a novel approach to the development of an artificial placenta.
Artif Organs. 1997, 21: 1239- 46.
[4] Otway N,
Ellis M. Construction and Test of an
Artificial Uterus for Ex Situ Development of Shark Embryos. Zoo Biology,
2012, 31: 197–205
[8] Hellström
M, El-Akouri RR, Sihlbom C, Olsson BM, Lengqvist J, Bäckdahl H, Johansson BR,
Olausson M, Sumitran-Holgersson S, Brännström M. Towards the development of a bioengineered uterus: comparison of
different protocols for rat uterus decellularization. Acta Biomater. 2014,
10: 5034-42.
[9] Miyazaki K,
Maruyama T. Partial regeneration and
reconstruction of the rat uterus through recellularization of a decellularized
uterine matrix. Biomaterials. 2014, 35: 8791-800
5
Centres ayant
pratiqués les greffes d’utérus-vagins dans le monde :
|
Centre |
Coordonnées |
Contacts / tel / email |
Age patiente |
Raison(s) |
Techniques |
Dates intervention |
|
Wake
Forest Institute Baptist Medical Center for regenerative
medecine |
Richard H. Dean Biomedical Building 391 Technology Way Winston-Salem, NC 27101 (North Carolina, USA) |
Dr Anthony Atala (Director). Tel 336-713-7293 Email
: regenmed
@ wakehealth.edu |
13 à 18 ans |
Culture
tissulaire |
10/04/2014 |
|
|
Policlinico Umberto I hospital, Rome, Italie |
Viale del Policlinico, 155, 00161
Roma, Italie |
Dr. Cinzia Marchese Email : cinzia.marchese @ uniroma1.it |
28 ans et
17 ans |
Culture
tissulaire |
2007 ? |
|
|
Department of Obstetrics
& Gynecology, University of Gothenburg, Sweden |
Kvinnokliniken Su
Ostra, 41685 Göteborg Sahlgrenska University Hospital, Östra, SE 416 85
Gothenburg (ou Göteborg) |
Prof. Mats Brännström Tel : +46 31-343 4216 Email : mats.brannstrom @ obgyn.gu.se |
|
idem |
Culture tissulaire
: 9 bénéficiaires Donation de la
mère à la fille (greffe de vagin) |
09/2012 04/2013 (greffe) Naissance :
Oct 2014 |
|
Akdeniz University, Turquie |
Faculty
of Medicine. Department of Plastic and Reconstructive. Surgery. Antalya, Turkey |
Pr. Ömer Özkan Email : Dr Munire Erman Akar |
21 ans (Derya
Sert) |
Idem |
Greffe de vagin |
08/2011 Avortement
spontané du fœtus |
6
Spécialistes
ayant étudiés ou pratiqués les greffes d’utérus-vagin :
|
Praticien |
Titre/compétence |
Coordonnées |
Email / Tél. |
Remarques |
|
Atlantida M.
Raya-Rivera |
|
Hospital
Infantil de México Federico Gómez, Doctor Márquez 162, Doctores, Cuauhtémoc,
06720 Cuauhtémoc, Distrito Federal, Mexico |
Tél +52 55 5228
9917 Email : |
|
|
Director
of Wake Forest Institute for regenerative
medecine |
Wake Forest Institute for
Regenerative Medicine (WFIRM, North Carolina, USA) |
Tel 336-713-7293 Email
: regenmed
@ wakehealth.edu |
|
|
|
Zhang Xiao-jie Zhang Yuanyuan Zhang ? |
Professeur adjoint. |
Wake Forest
Institute for Regenerative Medicine Wake Forest Baptist Medical
Center |
Coordonnées Universitaire: 336-713-1189. Département:
336-716-2011 Yzhang @ wakehealth.edu |
Nom et coordonnées à vérifier. |
|
Prof. Mats Brännström |
Professor and Chairman, Sahlgrenska Academy, University of
Gothenburg Head of the Department of Obstetrics and Gynecology |
Department of Obstetrics
& Gynecology, University of Gothenburg, Sweden |
Tel :
46-31-343 4216 |
|
|
Klaus Groth |
|
Department of Obstetrics
& Gynecology, Institute of Clinical Science, Sahlgrenska Academy,
University of Gothenburg |
Tel:
+46-31-342-10-00 klaus.groth
@ vgregion.se |
|
|
Dr. Cinzia Marchese |
Tecniche di laboratorio
biomedico (abilitante alla professione sanitaria di Tecnico di laboratorio
biomedico) Corso di laurea A - Roma Azienda Policlinico Umberto I |
Rome's Policlinico Umberto I hospital. Azienda Policlinico
Umberto I - Aula Psicologia Medica - Città Universitaria - |
cinzia.marchese @
uniroma1.it |
|
|
Pierluigi
Benedetti Panici |
|
Department of Gynaecology,
Obstetrics and Perinatology, University of Rome “La Sapienza”, V.le Regina
Elena, 324, 00161 Rome, Italy |
pierluigi.benedettipanici @ uniroma1.it Tel: +39-3483410486 |
|
|
Vijayalakshmi
Pillai |
Medican Director |
Vijayalakshmi
Medical Centre |
|
|
|
Irene Cervelló |
Fundación
Instituto Valenciano de Infertilidad (FIVI), Department of Obstetrics &
Gynecology, School of Medicine, Valencia University and Valencia University
and Instituto Universitario IVI/INCLIVA, Valencia, Spain |
Fundación
IVI, Instituto Universitario IVI, Department of Obstetrics ... University of
Valencia, INCLIVA, Valencia |
irene.cervello @
ivi.es |
|
|
Pr. Ömer Özkan |
Obstétrique et
gynécologie |
Akdeniz University Hospital in Antalya |
|
|
|
Dr Munire Erman Akar |
Obstétrique et
gynécologie |
Akdeniz University Hospital in Antalya |
Tel:
249 65 71 Meakar
@ akdeniz.edu.tr |
|
7
Annexe : sur
la culture tissulaire de cellule, évitant le risque de rejet
7.1
UN CŒUR NEUF
CONTRE LES REJETS
Dans le monde, de personnes souffrent
actuellement plus de 25 millions C d’insuffisance cardiaque. En 2014, en
France, 361 personnes étaient en attente d’une transplantation cardiaque ou
cardiopulmonaire et un peu plus de 20 % d’entre elles sont mortes faute de
greffe. Mais le manque de donneurs n’est pas le seul obstacle que doivent
surmonter les malades. Une fois l’organe remplacé, ils courent le risque d’un rejet du greffon, mortel dans un peu moins de
5 % des cas. Pour lutter contre tous ces problèmes, la médecine œuvre
depuis plusieurs années à la conception d’un cœur synthétique créé à partir
des propres cellules du patient. Selon une étude publiée début 2016 dans la
revue Circulation Research, une équipe du Massachusetts General Hospital,
l’hôpital de la faculté de médecine de Harvard, a créé en laboratoire un cœur
humain quasi transplantable.
En vidant l’organe d’un donneur
de ses cellules les plus dangereuses en matière de compatibilité avec le
receveur, les chercheurs ont pu concevoir une armature-matrice
conservant les structures les plus essentielles, et les moins facilement
copiables, d’un cœur fonctionnel, avant de la repeupler par les cellules
souches du receveur, générées à partir de cellules
cutanées. Menée par Harald Ott, cette même équipe avait mis au point
en 2008 la procédure permettant de «nettoyer» les cellules vivantes de
l’organe du donneur et de la recellulariser avec des cellules parfaitement
compatibles avec le receveur. Une technique éprouvée avec succès sur des
cœurs, des poumons et des reins de souris mais aussi de plus grands mammifères.
L’étude publiée dans Circulation Research est la première à en détailler la
réussite sur des cœurs humains.

Avant
d’être réimplanté, l’organe a été repeuplé par les cellules souches du
receveur.
© B. JANK/MD/OTT
LAB/CENTER FOR REGENERATIVE MEDEDCINE/MASSACHUSETTS HOSPITAL
Source :
Direct Matin, page 6, N° 1854 VENDREDI 25 MARS 2016.
7.2 Un cœur humain quasi transplantable créé à partir
de cellules souches
Repéré
par Peggy
Sastre
21.03.2016 - 17 h 36
La bio-ingénierie n’a jamais été aussi près d’offrir une
nouvelle solution thérapeutique aux malades.
Dans le monde, plus de 25 millions de personnes souffrent
actuellement d’insuffisance cardiaque.
En France, en 2014, 361 personnes étaient en attente d’une
transplantation cardiaque ou cardiopulmonaire et un peu plus de 20% d’entre elles
sont mortes faute de greffe. Mais le manque de donneurs n’est pas le seul
obstacle que doivent surmonter les malades. Une fois l’organe remplacé, ils
courent encore le risque d’un rejet du greffon, mortel dans un peu moins de 5% des cas.
Pour lutter contre tous ces problèmes, la médecine œuvre depuis
plusieurs années à la conception d’un cœur synthétique créé à partir des
propres cellules du patient. Et selon une étude publiée
début 2016 dans la revue Circulation Research, une équipe du Massachusetts
General Hospital –l’hôpital de la faculté de médecine de Harvard–, c’est un
cœur humain quasi transplantable qui vient d’être généré en laboratoire.
En vidant l’organe d’un donneur de ses cellules les plus
dangereuses en matière d’histocompatibilité, les chercheurs ont pu
concevoir une armature-matrice conservant les structures les plus essentielles
–et les moins facilement copiables– d’un cœur fonctionnel, avant de la
repeupler par les cellules souches du receveur, générées à partir de cellules
cutanées.
7.2.1
« Machine à
cœur »
Menée par Harald Ott, cette même équipe avait mis au
point en 2008 la procédure permettant de «nettoyer» les cellules vivantes de l’organe du donneur
et de la recellulariser avec des cellules parfaitement compatibles avec le
receveur. Une technique éprouvée avec succès sur des cœurs, des poumons et des
reins de souris mais aussi de plus grands mammifères. L’étude publiée dans
Circulation Research est la première à en détailler la réussite sur des cœurs
humains.
Pour ce faire, les scientifiques ont dû concevoir un bioréacteur
capable de contenir un cœur humain entier pendant tout le processus de
recellularisation. Cette «machine à cœur» aura été testée avec succès sur
soixante-treize organes collectés par l’agence de biomédecine de
Nouvelle-Angleterre. Chaque organe est resté en culture pendant 120 jours et
les études de compatibilité effectuées à la fin du processus montrent une
absence d’antigènes HLA,
molécules responsables des réactions de rejet.
Pour le magazine Popular Science,
nous n’avons jamais été aussi loin dans la conception in vitro de cœurs humains transplantables –et
la bio-ingénierie jamais été aussi près d’offrir une nouvelle solution
thérapeutique aux malades, capable, cerise sur le gâteau, de contourner bien
des obstacles bioéthiques.
Source : http://www.slate.fr/story/115685/coeur-humain-quasi-transplantable-cellules-souches
Traduction
française :
recherche originale
7.3
Bioengineering
du Myocarde humain sur une matrice extracellulaire native
+Auteur Affiliations
1.
↵ * hott@mgh.harvard.edu
Résumé
Justification: Plus de 25 millions de personnes souffrent d'insuffisance
cardiaque à travers le monde,
avec près de 4000 patients
actuellement en attente d'une
transplantation cardiaque aux États-Unis. La
pénurie d'organes de donneurs et le rejet d'allogreffe demeurent des
limitations avec seulement environ 2500 cœurs transplantés chaque année. Comme une alternative théorique
allotransplantation, patient dérivé myocardique bioartificiel pourrait fournir
un appui fonctionnel et
,finalement , un impact sur le traitement de l' insuffisance cardiaque.
Objectif: L'objectif de cette étude est de traduire
les travaux antérieurs à l' échelle humaine et les cellules cliniquement pertinentes,
pour la bioingénierie de tissu myocardique fonctionnelle basée sur la
combinaison de la matrice
cardiaque humaine et des cardiomyocytes iPS dérivées.
Méthodes
et résultats: Pour
fournir un échafaudage de tissu cliniquement pertinent, nous avons traduit
perfusion-décellularisation à l' échelle
humaine et obtenu échafauds humains acellulaire cardiaques biocompatibles avec
la composition préservée de la matrice
extracellulaire, l' architecture
et la vascularisation coronarienne perfusable. Nous avons ensuite repeuplée cette
matrice cardiaque humaine native avec des cardiomyocytes
dérivés de cellules humaines non transgénique induite souches pluripotentes
(CISP) et les tissus générés
d'une complexité croissante en trois
dimensions. Nous avons maintenu
de telles constructions de tissus cardiaques en culture pendant 120 jours pour
démontrer la structure définitive
sarcomère, cellulaire et de la matrice
de déformation, la force
contractile et la conduction
électrique. Pour montrer que le
tissu myocardique fonctionnelle de l' échelle
humaine peut être construit sur cette plate - forme, nous avons ensuite
partiellement recellularisé humains échafauds cardiaques entiers avec
cardiomyocytes humains iPSC dérivées. Sous
culture biomimétique, les constructions ensemencées développées générateur de force du tissu myocardique humaine,
ont montré une conductivité
électrique, le développement gauche de la pression
ventriculaire, et la fonction
métabolique.
Conclusions: autochtones cardiaques échafauds de la matrice extracellulaire maintiennent
les composants de la matrice et de la structure pour soutenir
l'ensemencement et greffe de iPS dérivées cardiomyocytes humains, et permettent
à la bioingénierie du tissu
myocardique comme humain fonctionnel de multiples complexités.
Mots clés:
·
Commandée par pression de
perfusion décellularisation
·
la différenciation cardiaque
·
Reçu le 20 mai 2015.
·
Révision reçu 6 Octobre 2015.
·
Accepté 26 Octobre 2015.
Source : http://circres.ahajournals.org/content/early/2015/10/26/CIRCRESAHA.115.306874
http://circres.ahajournals.org/content/118/1/56
7.4 Bioengineering Human Myocardium on Native Extracellular Matrix
+Author Affiliations
7.4.1 Abstract
Rationale: More than 25 million individuals suffer from heart failure
worldwide, with nearly 4,000 patients currently awaiting heart transplantation
in the United States. Donor organ shortage and allograft rejection remain major
limitations with only about 2,500 hearts transplanted each year. As a
theoretical alternative to allotransplantation, patient-derived bioartificial
myocardium could provide functional support and ultimately impact the treatment
of heart failure.
Objective: The objective of this study is to translate previous
work to human scale and clinically relevant cells, for the bioengineering of
functional myocardial tissue based on the combination of human cardiac matrix
and human iPS-derived cardiomyocytes.
Methods and Results: To provide a clinically relevant tissue scaffold, we
translated perfusion-decellularization to human scale and obtained
biocompatible human acellular cardiac scaffolds with preserved extracellular
matrix composition, architecture, and perfusable coronary vasculature. We then
repopulated this native human cardiac matrix with cardiomyocytes derived from
non-transgenic human induced pluripotent stem cells (iPSCs) and generated
tissues of increasing three-dimensional complexity. We maintained such cardiac
tissue constructs in culture for 120 days to demonstrate definitive sarcomeric
structure, cell and matrix deformation, contractile force, and electrical
conduction. To show that functional myocardial tissue of human scale can be
built on this platform, we then partially recellularized human whole heart
scaffolds with human iPSC-derived cardiomyocytes. Under biomimetic culture, the
seeded constructs developed force-generating human myocardial tissue, showed
electrical conductivity, left ventricular pressure development, and metabolic
function.
Conclusions: Native cardiac extracellular matrix scaffolds maintain
matrix components and structure to support the seeding and engraftment of human
iPS-derived cardiomyocytes, and enable the bioengineering of functional human
myocardial-like tissue of multiple complexities.
Key Words:
·
Pressure-controlled perfusion decellularization
·
Received May 20, 2015.
·
Revision received October 6, 2015.
·
Accepted October 26, 2015.
Source : http://circres.ahajournals.org/content/early/2015/10/26/CIRCRESAHA.115.306874
http://circres.ahajournals.org/content/118/1/56
7.5
SCIENTISTS GROW FULL-SIZED,
BEATING HUMAN HEARTS FROM STEM CELLS
IT’S THE CLOSEST WE'VE COME TO GROWING TRANSPLANTABLE HEARTS IN THE LAB
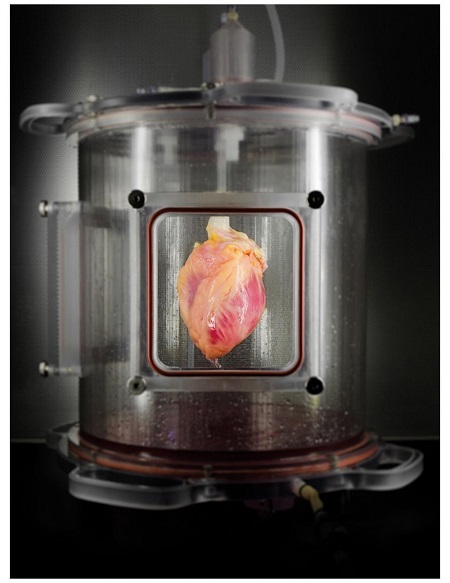
Regenerated heart
Heart tissue, seeded
with induced cardiac cells, matures in a bioreactor that the researchers
created
Of the 4,000 Americans waiting for heart transplants, only 2,500 will
receive new hearts in the next year. Even for those lucky enough to get a
transplant, the biggest risk is the their bodies will reject the new heart and
launch a massive immune reaction against the foreign cells. To combat the
problems of organ shortage and decrease the chance that a patient’s body will
reject it, researchers have been working to create synthetic organs from
patients’ own cells. Now a team of scientists from Massachusetts General
Hospital and Harvard Medical School has gotten one step closer, using adult
skin cells to regenerate functional human heart tissue, according to a study published recently in the journal Circulation
Research.
Ideally, scientists would be able to grow working hearts from patients’
own tissues, but they’re not quite there yet. That’s because organs have a
particular architecture. It's easier to grow them in the lab if they have a
scaffolding on which the cells can build, like building a house with the frame
already constructed.
In their previous work, the scientists created a technique in which they
use a detergent solution to strip a donor organ of cells that might set off an
immune response in the recipient. They did that in mouse hearts, but for this
study, the researchers used it on human hearts. They stripped away many of the
cells on 73 donor hearts that were deemed unfit for transplantation. Then the
researchers took adult skin cells and used a new technique with messenger RNA
to turn them into pluripotent stem cells, the cells that can become specialized
to any type of cell in the human body, and then induced them to become two
different types of cardiac cells.
After making sure the remaining matrix would provide a strong foundation
for new cells, the researchers put the induced cells into them. For two weeks
they infused the hearts with a nutrient solution and allowed them to grow under
similar forces to those a heart would be subject to inside the human body.
After those two weeks, the hearts contained well-structured tissue that looked
similar to immature hearts; when the researchers gave the hearts a shock of
electricity, they started beating.
While this isn’t the first time heart tissue has
been grown in the lab, it’s the closest researchers have come to their end
goal: Growing an entire working human heart. But the researchers admit that
they’re not quite ready to do that. They are next planning to improve their
yield of pluripotent stem cells (a whole heart would take tens of billions, one
researcher said in a press release), find a
way to help the cells mature more quickly, and perfecting the body-like
conditions in which the heart develops. In the end, the researchers hope that
they can create individualized hearts for their patients so that transplant
rejection will no longer be a likely side effect.
TAGS:
·
HEARTS
·
HEALTH
Source : http://www.popsci.com/scientists-grow-transplantable-hearts-with-stem-cells